La première partie, parue dans le numéro précédent, a porté sur les fractures sous-chondrales par insuffisance simples (Subchondral Insufficiency Fractures ou SIF) ou avec ostéonécrose (Subchondral Insufficiency Fractures with OsteoNecrosis ou SIF-ON).
Cette seconde partie porte sur des lésions qui peuvent présenter des points communs et porter à des diagnostics différentiels.
| 2ème partie |
AUTRES LÉSIONS POUVANT MIMER LES FRACTURES SOUS-CHONDRALES PAR INSUFFISANCE SIMPLES (SIF) OU AVEC OSTÉONÉCROSE (SIF-ON)
De nombreuses autres conditions peuvent induire dans un genou un signal médullaire de type oedémateux, par exemple en réaction à des lésions inflammatoires (ostéite, arthrite), à des tumeurs bénignes (ostéome ostéoïde, chondroblastome...) ou malignes. Parfois, la cause est évidente, comme pour les oedèmes médullaires postcontusionnels qui disparaissent après quelques semaines ou mois. D'autres cas sont liés à une réaction à une affection chronique reconnaissable (comme l'arthrose, par exemple) ou entrent dans le cadre d’une affection mal connue comme le syndrome
douloureux régional complexe de type 1.
SYNDROME DOULOUREUX RÉGIONAL COMPLEXEDE TYPE 1 (SDRC 1)
Autrefois appelé algodystrophie ou dystrophie sympathique réflexe, le SDRC 1 est un trouble polymorphe, sans substrat biologique, bactériologique ou anatomique spécifique, dont le diagnostic présomptif repose sur une combinaison de critères cliniques et d'imagerie, incluant douleur locale ou loco-régionale, hyperesthésie cutanée, troubles vasculaires, oedème local ou loco-régional, raréfaction osseuse radiologique et activité augmentée
ou diminuée à la scintigraphie osseuse1.
L’affection peut être déclenchée par n'importe quoi (traumatisme, chirurgie, piqûre d'insecte…), ou peut survenir sans aucun déclencheur identifiable1. Son étiologie demeure inconnue. Il a été suggéré qu'un épisode ischémique local pourrait initier une chaîne d'événements entraînant un oedème médullaire, mais cette hypothèse manque d'arguments convaincants2.
La pathogénie de la douleur est mal comprise et probablement multifactorielle : dérégulation neurovégétative, augmentation de la pression intra osseuse avec irritation des nerfs sensoriels dans l'os, augmentation du turnover osseux avec ou sans microfractures2.
Finalement, il s'agit d'un diagnostic d'exclusion, c'est pourquoi l'imagerie peut être un outil précieux pour établir ou écarter d'autres causes potentielles2.
En IRM, des aspects de signal semblables à un oedème médullaire sont observés, précédant les changements radiographiques, et le terme de « syndrome d'oedème médullaire osseux transitoire » a été utilisé pour des cas où la radiographie est normale ou non disponible.
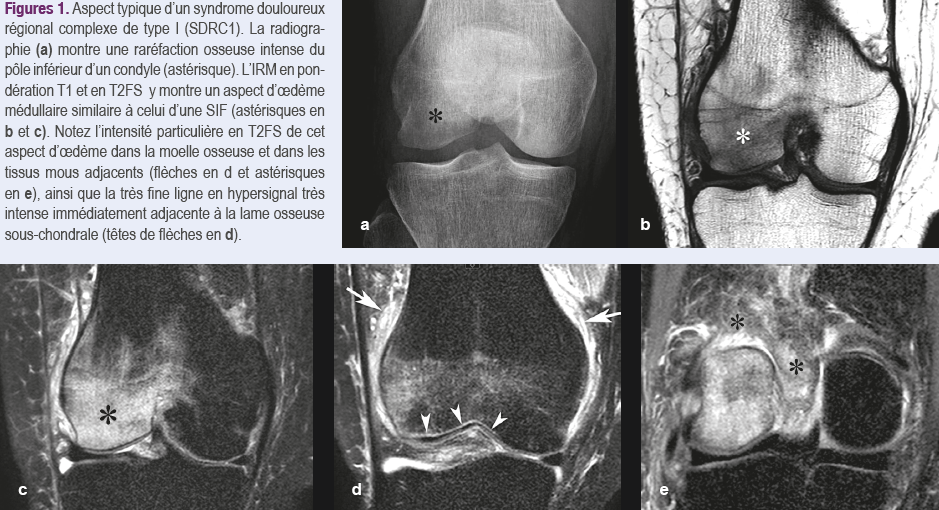
L’aspect radiologique typique est une transparence osseuse accrue, souvent hétérogène (aspect « moucheté » ou « pommelé »), qui apparaît 1 à 3 mois après le début des symptômes et qui peut, dans le genou, persister pendant de longs mois. Cette transparence osseuse accrue peut n'affecter qu'une partie de la zone anatomique, en particulier dans les lésions précoces (« algodystrophie partielle ») (Figure 1 a)4.
En IRM, les altérations sont similaires à celles observées dans la plupart des lésions épiphysaires transitoires : aspects d’oedème médullaire avec hyposignal en T1, hypersignal en T2FS (pour T2 avec saturation du signal de la graisse « fat ») et rehaussement du signal en T1 avec contraste, portant sur une portion plus ou moins étendue de l'épiphyse, et associés à un aspect d’oedème dans les tissus mous adjacents (Figures 1 b-e)5. Comme dans les SIF, une fine ligne en signal très intense en T2FS immédiatement adjacente à la lame osseuse sous-chondrale est fréquemment présente (Figure 1d)6.
Les changements dans la moelle osseuse en IRM précèdent la raréfaction osseuse radiographique de plusieurs semaines et peuvent régresser avant elle. Par conséquent, dans le cas d'un SDRC 1 chronique, l'aspect en IRM peut être normalisé, tandis que les altérations radiologiques et cliniques ne le sont pas2,7.
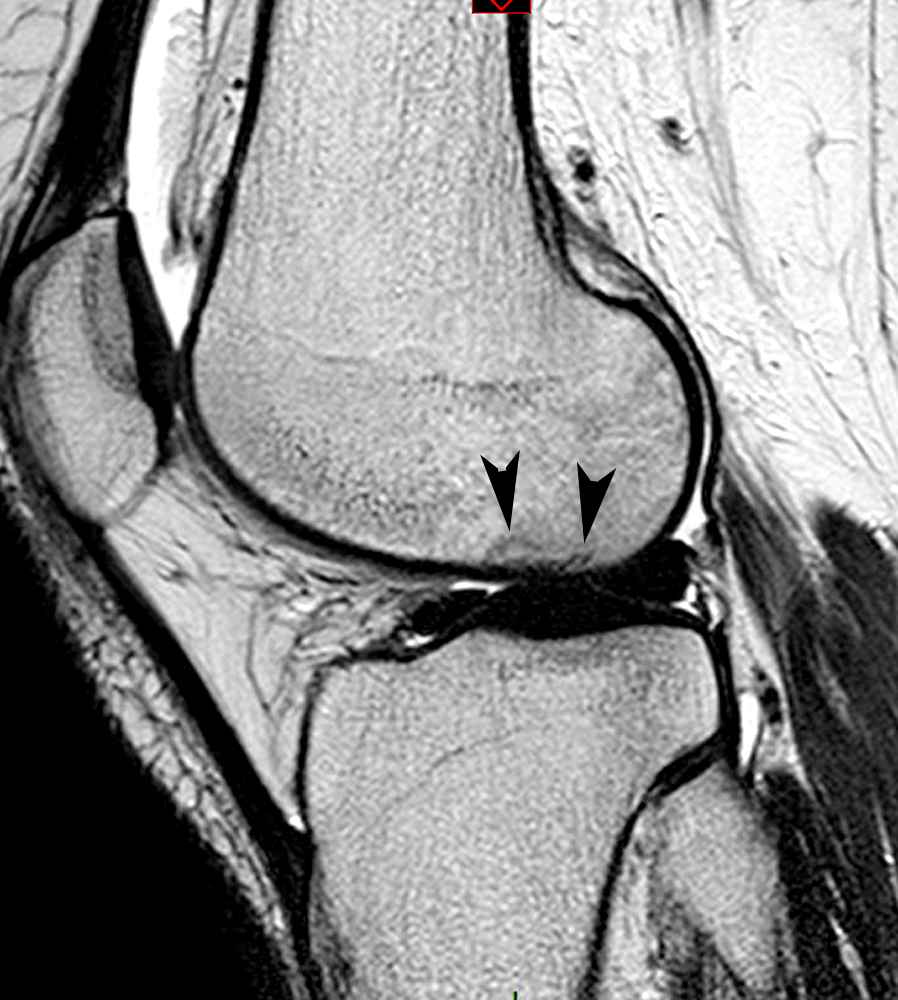
En pratique, il n'y a pas de différence notable entre l'apparence en IRM du SDRC 1 et celle des autres lésions épiphysaires transitoires, sauf que dans le SDRC 1 les réactions de type oedémateux dans l'os et les tissus mous sont souvent plus explosives et durent plus longtemps que dans les SIF (Figure 1e). Pour ajouter à la confusion, des déformations subtiles de la surface sous-chondrale et de fines lignes de fracture sous-chondrales peuvent également être observées dans le SDRC 1 (Figure 2)8,9.
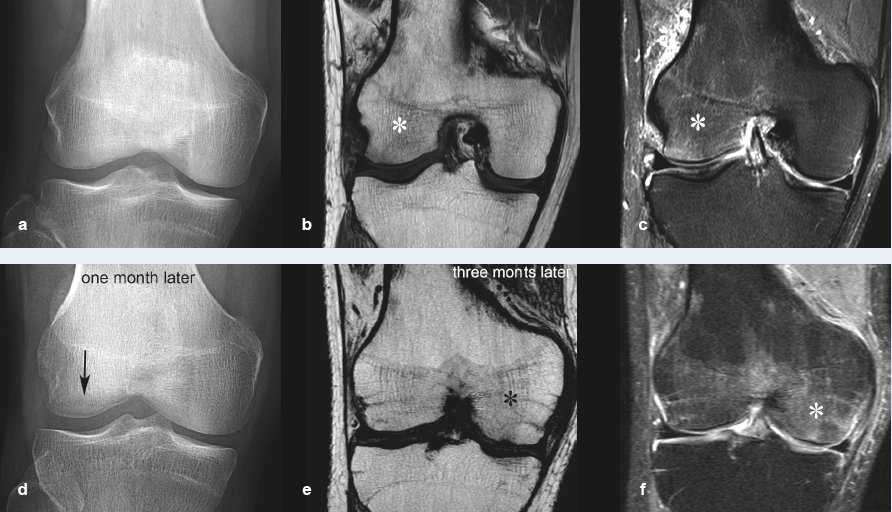
Mais l’oedème médullaire peut migrer d'une portion de l'épiphyse à une autre ou d'une épiphyse à une autre lors de contrôles successifs. Cette migration est la seule caractéristique définitive en IRM qui distingue le SDRC 1 des SIF ((Figures 3)5,10,11.
L'aspect en IRM des lésions du SDRC 1 est pratiquement similaire à celui des SIF, à part :
▸L'intensité souvent très élevée des réactions de type oedémateux.
▸La fréquente migration des lésions lors des contrôles.

SIGNAL DE TYPE OEDÉMATEUX ASSOCIÉ À DES LÉSIONS CHONDRALES
Un aspect de type oedémateux de la moelle osseuse sous-chondrale est fréquemment associé à des lésions arthrosiques, en particulier en cas de lésions en phase évolutive et symptomatique12. En histologie, cet aspect peut correspondre à diverses anomalies, incluant nécrose et fibrose médullaire, nécrose et remodelage trabéculaire, hémorragies, mais l’oedème n’est pas le constituant dominant13.
Les modifications médullaires sont généralement moins intenses et moins étendues dans l'arthrose que dans les SIF et leur localisation plus variée14. Le signal de type oedémateux peut être homogène en cas de chondropathie simple (Figures 4), mais il est le plus souvent hétérogène en cas d'arthrose évoluée, en raison de changements structurels intriqués à l'infiltration médullaire (hyperostose, nécrose, géodes, etc.) (Figures 5)15.
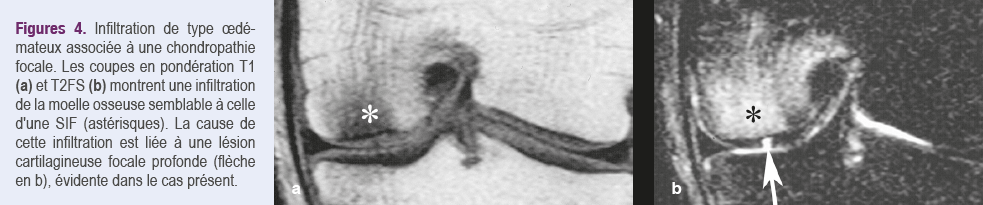
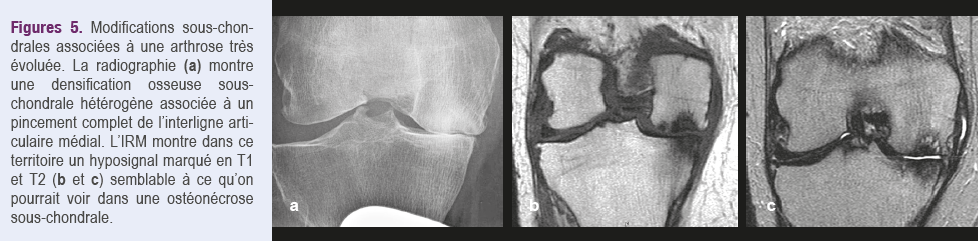
Il est donc possible de confondre les lésions de type oedémateux associées à l’arthrose, avec celles résultant des SIF ou des SIF-ON, d’autant que celles-ci sont également observées chez des personnes âgées qui présentent souvent un certain degré de chondropathie.
Cette confusion est manifeste dans certaines études qui, dans une même série, décrivent comme « Ostéonécroses spontanées » des lésions dont les genoux ont une destruction cartilagineuse complète et d’autres avec un cartilage intact (16 par exemple).
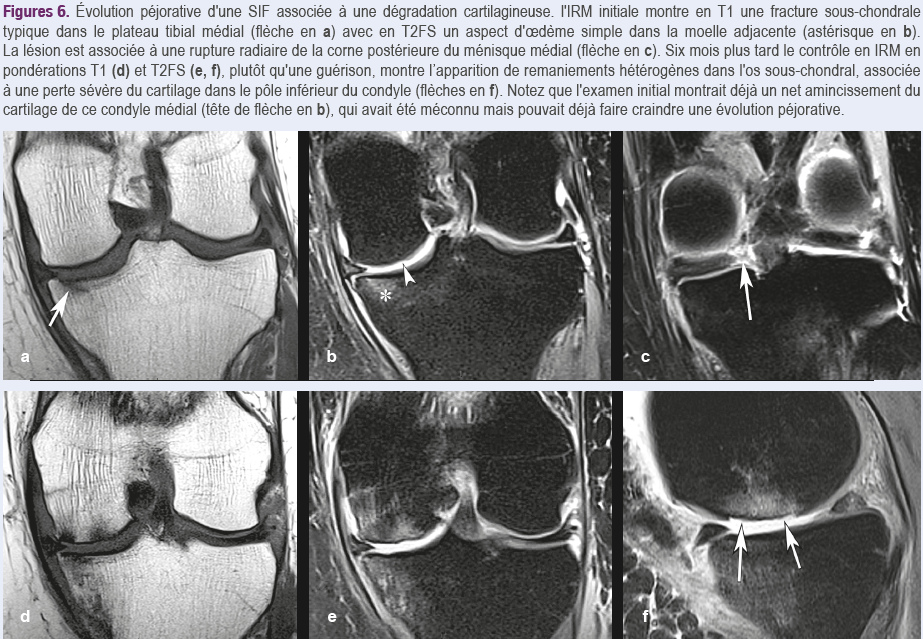
Il est cependant cliniquement important de distinguer les modifications de signal médullaire liées à l’arthrose de celles liées aux SIF, car ces dernières sont généralement réversibles, alors que dans une arthrose, le pronostic dépend non pas de l'aspect de l'oedème mais bien de la maladie cartilagineuse elle-même, qui évolue pour son propre compte (Figures 6). Mais attention, il faut bien regarder. Parfois la lésion cartilagineuse est
évidente… parfois pas… !
En cas de réaction médullaire à une dégradation cartilagineuse, le pronostic ne dépend pas de l’aspect de l'oedème médullaire mais de l'évolutivité propre de l’arthropathie.
OSTÉONÉCROSE D'ORIGINE SYSTÉMIQUE
Contexte nosologique
L'ostéonécrose ischémique ou avasculaire résulte d'une altération de l'apport sanguin à l'os, entraînant la mort irréversible des cellules osseuses (ostéoblastes,ostéoclastes, ostéocytes) et des cellules de la moelle osseuse (qui sont essentiellement des adipocytes dans les épiphyses)17. En dehors des causes traumatiques, l’ostéonécrose peut survenir par des mécanismes pas toujours bien élucidés chez des sujets présentant divers facteurs de risque (notamment l'hypercorticisme, l'alcoolisme, l'hyperuricémie, le lupus érythémateux, la drépanocytose et le VIH)18,19,20.
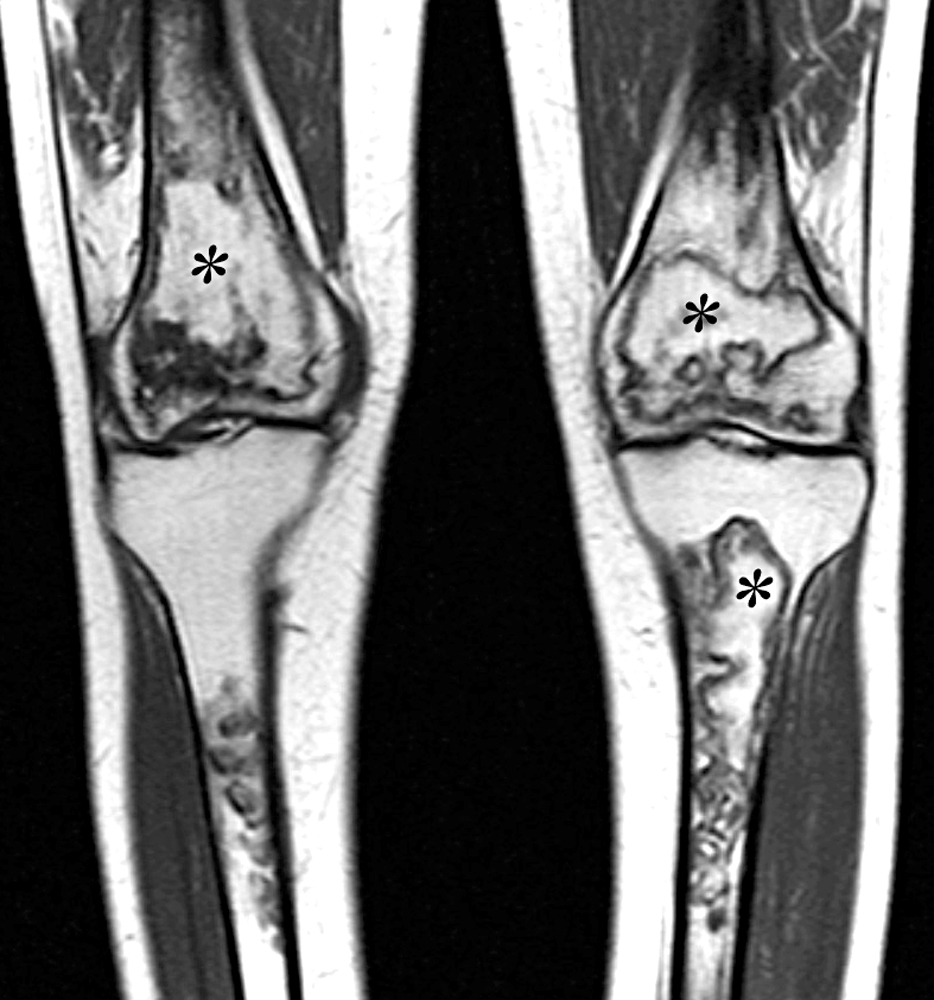
Les ostéonécroses systémiques surviennent dans des épiphyses et dans des régions diaphyso-métaphysaires, en particulier dans ou à proximité des hanches et des genoux. Les lésions sont bilatérales dans plus de 80 % des cas (Figure 7)21. Le terme de nécrose avasculaire est généralement utilisé pour les localisations épiphysaires tandis que le terme d'infarctus osseux est souvent réservé aux lésions diaphyso-métaphysaires. Pourtant, le terme d'ostéonécrose est approprié pour toutes les localisations d'os dévitalisé20.

En l’absence d’effondrement mécanique, ces lésions sont très généralement asymptomatiques (ostéonécroses dites « silencieuses »22). Les lésions métaphysaires sont donc très généralement asymptomatiques et pour les lésions épiphysaires, c’est lorsqu’un collapsus se produit que la lésion devient symptomatique21,23.
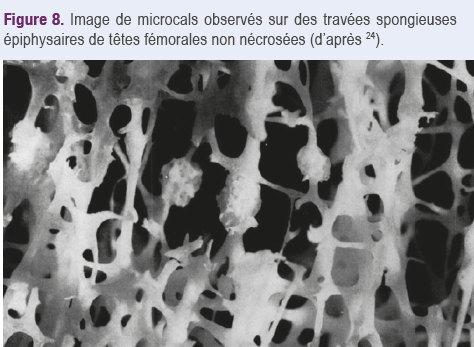
Pourquoi le collapsus peut-il survenir tardivement, parfois très tardivement, dans un territoire d'ostéonécrose avasculaire ? C'est que la nécrose des ostéocytes ou des cellules de la moelle osseuse ne modifie pas a priori la résistance mécanique des structures trabéculaires calcifiées. L’os d’un cadavre est d’ailleurs aussi résistant qu’un os vivant. Mais il est irréparable. Or, dans un os vivant, des microfractures trabéculaires induites par les
contraintes mécaniques ordinaires peuvent se réparer, comme le montre la présence de microcals entourant des travées spongieuses fissurées (Figure 8)24.
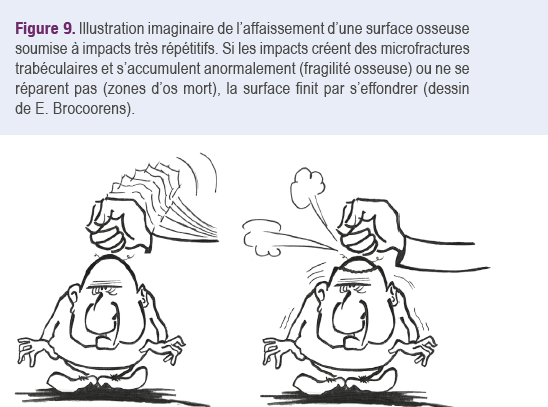
Mais si ces fractures physiologiques ne se réparent pas, leur accumulation peut entraîner progressivement une fragilisation osseuse excessive et un collapsus de l'épiphyse, comme suggéré dans un exemple imaginaire de l’effondrement d’une surface osseuse soumise à des impacts répétitifs (Figure 9). S’y ajoute le fait qu’en cas de nécrose avasculaire, un processus réactionnel de résorption-reconstruction peut y créer une zone de
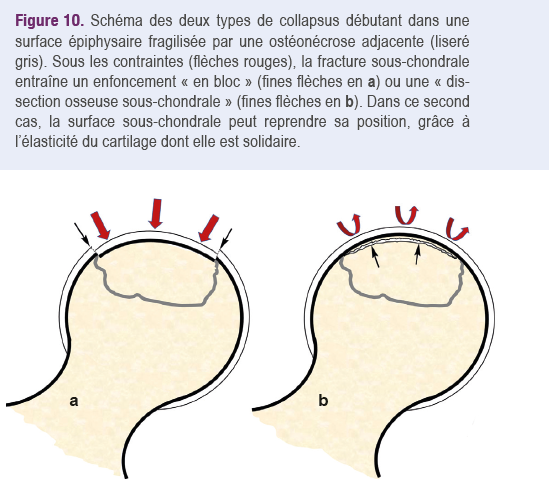
fragilité accrue. Les deux modes de collapsus débutant d'un territoire d'ostéonécrose épiphysaire sont soit un affaissement en bloc avec décrochement du contour épiphysaire, soit une dissection sous-chondrale. Celle-ci résulte d’une fracture avec enfoncement limité de l’os sous-chondral, suivie d’un retour de la lame osseuse sous-chondrale à sa position initiale grâce à l’élasticité du cartilage dont elle est solidaire (Figure 10).
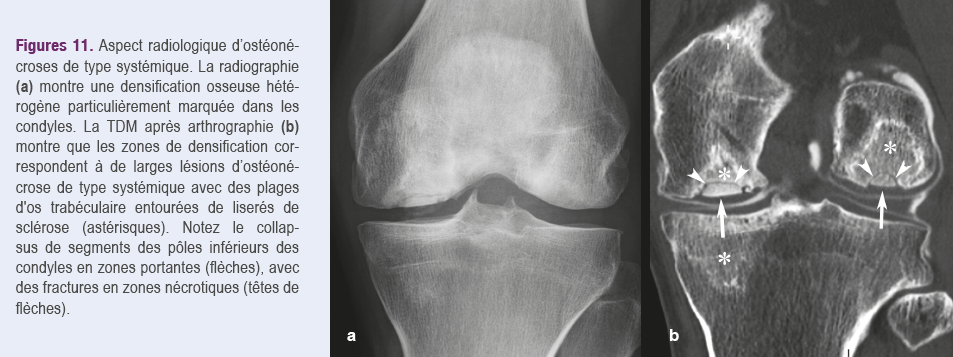
Aspect radiologique
La radiographie est normale pour les lésions précoces. Dans les stades plus avancés, l’ostéonécrose apparaît comme une plage de densification irrégulière résultant d’un liseré périphérique sinueux de sclérose qui peut être reconnu surtout en TDM (Figures 11). En cas de collapsus d’une lésion épiphysaire, apparaissent les signes pathognomoniques de l’affaissement. Tardivement, le collapsus peut progresser et les déformations
osseuses entrainer une arthrose secondaire20.
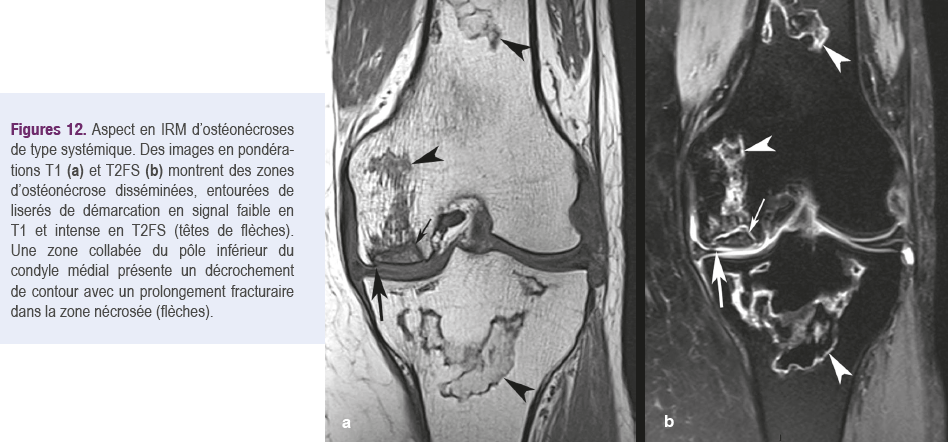
Aspect en IRM
La présence d’un liseré de démarcation entourant la zone d'ostéonécrose est l’anomalie la plus caractéristique, sous l'aspect d'une bande sinueuse en signal faible en T1 et plus varié en T220. Ce liséré correspond à une couche de tissu réactionnel autour de la zone d’ostéonécrose23. Lorsque la zone nécrotique englobe une portion de la surface osseuse, le liseré présente un aspect grossièrement hémisphérique ou conique entourant
une partie de l'épiphyse20. Dans les lésions non collabées et pas trop anciennes, le contenu de la zone nécrotique peut conserver un aspect graisseux normal, en signal intense en T1, correspondant à de la moelle graisseuse « momifiée » (Figures 12)9,25.
Mais dans les lésions chroniques, des modifications variées se produisent. Des tentatives de résorption-reconstruction à partir de la périphérie peuvent résorber plus ou moins une partie des territoires nécrosés et/ou les infiltrer par des remaniements tissulaires plus
ou moins intenses (fibrose, hyperostose...). S’y ajoutent les conséquences des collapsus sous-chondraux : dégradation physicochimique de la graisse (hyposignal en T1 et T2), fractures sous-chondrales à contenu liquidien, développement de cavités géodiques, puis tardivement remaniement arthrosique global de l’articulation adjacente...9.
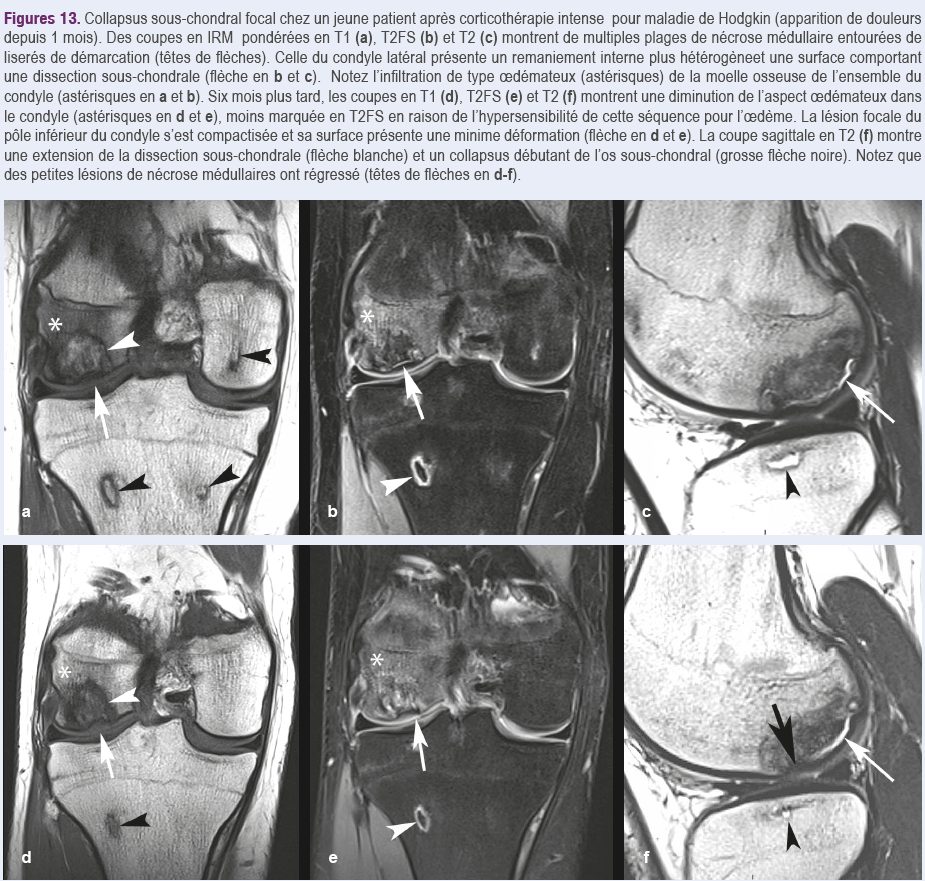
Dans une phase aiguë de collapsus, la moelle osseuse autour de la zone de nécrose peut présenter une infiltration de type oedémateux (Figures 13)15,26.
CONCLUSIONS > 1re et 2e parties
Les lésions épiphysaires d’apparition spontanée comportent les fractures sous-chondrales par insuffisance simples (SIF) ou compliquées d'ostéonécrose (SIF-ON). Elles forment une entité nosologique commune, aux pronostics différents. En gros, il y a celles qui se réparent et celles qui évoluent mal, se collabent et se nécrosent. Dans les premiers stades, l’analyse du territoire sous-chondral peut aider à reconnaître le
risque de progression d’une SIF vers une SIF-ON, quand ce territoire comporte une couche épaisse et/ou étendue de moelle osseuse dégradée en hyposignal en T2.
Les SDRC 1 peuvent paraître en IRM très similaires à des SIF, mais sont souvent caractérisés pas un aspect d’oedème médullaire plus intense, une persistance plus prolongée et un caractère migrateur très caractéristique. Ces lésions restent réversibles dans la grande majorité des cas.
Les lésions cartilagineuses peuvent induire des modifi cations médullaires sous-chondrales qui peuvent mimer les SIF. Cependant, les oedèmes médullaires liés à des lésions cartilagineuses doivent être reconnus, car leur pronostic ne dépend pas de l’aspect de la moelle osseuse elle-même mais du génie évolutif propre de la maladie cartilagineuse.
Les ostéonécroses d'origine systémique résultent d'une ischémie initiale. Les lésions sont délimitées par un liseré de démarcation caractéristique. Elles peuvent se compliquer d’un collapsus épiphysaire quand elles sont situées en surface portante et de complications arthrosiques quand elles sont de grandes dimensions.
Les auteurs déclarent ne pas avoir de lien d’intérêt.
NB : Ce texte reprend de larges parties d’un article récent des auteurs : Subchondral insufficiency fractures, subchondral insufficiency fractures with osteonecrosis, and other apparently spontaneous subchondral bone lesions of the knee - pathogenesis and diagnosis at imaging. Insights Imaging. 2023 Oct 2;14(1):164. Il est d’accès libre et peut être facilement téléchargé via « PubMed ».
RÉFÉRENCES
⬧1. Doury P. Bone-marrow oedema, transient osteoporosis, and algodystrophy [letter]. J Bone Joint Surg Br 1994; 76: 993-994. ⬧2. Patel S. Primary bone marrow oedema syndromes. Rheumatology (Oxford). 2014;53:785-92. ⬧3. Harden RN, Bruehl S, Perez R et al. Validation of proposed diagnostic criteria (the "Budapest Criteria") for Complex Regional Pain Syndrome. Pain. 2010;150:268-274. ⬧4. Lequesne M, Kerboull M, Bensasson M et al. L’algodystrophie décalcifi ante partielle. Rev Rhum Mal Osteoartic 1979; 46: 111-121. ⬧5. Karantanas AH, Nikolakopoulos I, Korompilias AV et al. Regional migratory osteoporosis in the knee: MRI fi ndings in 22 patients and review of the literature. Eur J Radiol. 2008;67:34-41. ⬧6. Gondim Teixeira PA, Balaj C, Marie B et al. Linear signal hyperintensity adjacent to the subchondral bone plate at the knee on T2-weighted fat-saturated sequences: imaging aspects and association with structural lesions. Skeletal Radiol. 2014;43:1589-98. ⬧7. Malghem J, Vande Berg B, Lecouvet F et al. Lésions épiphysaires, nécroses et oedèmes. In. Imagerie de l'appareil musculo-squelettiqie. Textes choisis. J. Malghem, B. Maldague, B. Vande Berg et F. Lecouvet Ed. Sauramps Médical. Montpellier 2010. p. 131-148. ⬧8. Maldague B, Vande Berg B, Malghem J. Ostéonécrose et pseudo-ostéonécroses de la tête fémorale. In : IRM ostéo-articulaire, GETROA Opus XVII, pp 169-190, Ed. Sauramps Medical, Montpellier, 1990. ⬧9. Vande Berg BE, Malghem JJ, Labaisse MA et al. MR imaging of avascular necrosis and transient marrow edema of the femoral head. Radiographics. 1993;13:501-20. ⬧10. Moosikasuwan JB, Miller TT, Math K et al. Shifting bone marrow edema of the knee. Skeletal Radiol. 2004;33:380-5. ⬧11. Aigner N, Meizer R, Petje G et al. Natural course of intra-articular shifting bone marrow edema syndrome of the knee. BMC Musculoskelet Disord. 2008; 9: 45. ⬧12. Felson DT, Chaisson Ch E, Hill CL et al. The association of bone marrow lesions with pain in knee osteoarthritis. Ann Intern Med 2001; 134: 541-549. ⬧13. Zanetti M, Bruder E, Romero J et al., Hodler J. Bone marrow edema pattern in osteoarthritic knees : correlation between MR imaging and histologic fi ndings. Radiology 2000; 215: 835-840. ⬧14. Ramnath RR, Kattapuram SV. MR appearance of SONK-like subchondral abnormalities in the adult knee: SONK redefi ned. Skeletal Radiol. 2004;33:575-81. ⬧15. Maraghelli D, Brandi ML, Matucci Cerinic M et al. Edema-like marrow signal intensity: a narrative review with a pictorial essay. Skeletal Radiol. 2021;50:645-663.
⬧16. Sayyid S, Younan Y, Sharma G et al. Subchondral insuffi ciency fracture of the knee: grading, risk factors, and outcome. Skeletal Radiol. 2019;48:1961-1974. ⬧17. Palmer W, Bancroft L, Bonar F. Glossary of terms for musculoskeletal radiology. Skeletal Radiol. 2020;49 (Suppl 1):1-33. ⬧18. Kattapuram TM, Kattapuram SV. Spontaneous osteonecrosis of the knee. Eur J Radiol. 2008;67:42-8. ⬧19. Lecouvet FE, Malghem J, Maldague BE et al. MR imaging of epiphyseal lesions of the knee: current concepts, challenges, and controversies. Radiol Clin North Am. 2005;43:655-72, vii-viii. ⬧20. Murphey MD, Foreman KL, Klassen-Fischer MK et al. From the radiologic pathology archives imaging of osteonecrosis: radiologic-pathologic correlation. Radiographics. 2014;34:1003-28. ⬧21. Mont MA, Baumgarten KM, Rifai A et al. Atraumatic osteonecrosis of the knee. J Bone Joint Surg Am. 2000;82:1279-90. ⬧22. Malghem J., Maldague B. Aspect radiologique des nécrosesépiphysaires et implications pathogéniques. Acta Orthopedica Belgica. 1981;47:200-224. ⬧23. Gorbachova T, Amber I, Beckmann NM et al. Nomenclature of Subchondral Nonneoplastic Bone Lesions. AJR Am J Roentgenol. 2019;213:963-982. ⬧24. Todd RC, Freeman MA, Pirie CJ. Isolated trabecular fatigue fractures in the femoral head. J Bone Joint Surg Br. 1972 Nov;54(4):723-8. ⬧25. Mitchell DG, Rao VM, Dalinka MK et al. Femoral head avascular necrosis: correlation of MR imaging, radiographic staging, radionuclide imaging, and clinical fi ndings.


