Dans les années 90 le développement des premières biothérapies a révolutionné la Rhumatologie et a transformé notre pratique. La stratégie très empirique de l’époque « pré biothérapie » utilisant les corticoïdes, les anti inflammatoires ou des médicaments classés comme chimiothérapie tel que le cyclophosphamide a évolué vers une stratégie plus ciblée. Avec l’arrivée des anti TNF, on modulait le système immunitaire en bloquant uniquement le TNF sans avoir d’effet immunosuppresseur.
1- INTRODUCTION ET CONCEPT GÉNÉRAL
L’étude du système immunitaire et l’apport de la recherche translationnelle nous ont permis de mieux comprendre les mécanismes physiopathologiques impliqués dans les maladies à médiation immunitaire (IMIDs). Nous avons pu identifier des cellules et des molécules clés (telles que le TNF) à l’origine de ces maladies. Cela a conduit Dennis Mcgonagle1 à proposer une classification des IMIDs corrélée à l’implication des différents acteurs du système immunitaire. Dans cette classification, les auteurs opposaient les maladies auto-immunes impliquant le bras adaptatif du système immunitaire aux maladies auto-inflammatoires impliquant principalement le bras inné du système immunitaire (Figure 1).
Figure 1. Concept d’auto inflammation/auto immunité.

Deux options semblent prometteuses :
Au cours de la réponse immunitaire, l'activation des lymphocytes nécessite trois signaux clés. Ces signaux permettent aux lymphocytes de détecter et de répondre correctement aux pathogènes, ainsi que de participer à des réponses immunitaires adaptées.
• Signal 1 : Reconnaissance spécifique de l'antigène par le récepteur des lymphocytes T (TCR) ou B (BCR).
• Signal 2 : Co-stimulation via des molécules comme CD28 (sur les lymphocytes T) ou CD40 (sur les lymphocytes B), fournissant une activation secondaire.
• Signal 3 : Cytokines, qui modulent la différenciation, l'amplification et l'efficacité de la réponse immune.
Ces trois signaux sont essentiels pour l'activation complète et la régulation des lymphocytes.
L’abatacept fut l’une des premières molécules tirant partie du signal 2. L’abatacept est composé de la partie Fc d’une immunoglobuline et de la molécule CTLA4 . Il se lie spécifaiquement au CD80 et au CD86 présents sur les cellules présentatrices d’antigène, empêchant ainsi leur interaction avec le CD28 sur les cellules T. Cela bloque le deuxième signal nécessaire à l'activation des cellules T (Figure 2).
C’est ce mécanisme d’action qui a donné naissance à l’immunothérapie en cancérologie. L’ère de l’immunothérapie a conduit à l’identification de nombreuses molécules inhibitrices (telles que PD1 et PDL1) et activatrices (comme CD40 et CD40L) de co signal qui sont à leur tour testées dans les maladies à médiation immunitaire.
Des essais de phase 1 et 2 sont ainsi en cours dans la polyarthrite rhumatoïde pour
• Des agonistes de PD1 et PDL1 (NCT06041269)
• Des anti OX40 et OX40L (NCT06181786)
• Des anti CD40 et CD40L (NCT02780388)
4- SAUVONS LES INHIBITEURS DE JAK GRÂCE À LA SÉLECTIVITÉ
Les molécules JAK (Janus Kinases) sont des protéines kinases cytoplasmiques qui jouent un rôle central dans la transmission de signaux via des récepteurs de cytokines et de facteurs de croissance.
Les JAK sont une famille de quatre protéines kinases :
• JAK1
• JAK2
• JAK3
• TYK2 (Tyrosine Kinase 2)
La fixation d’une cytokine ou d’un facteur de croissance à son récepteur spécifique induit l’activation des JAK qui se trouvent en aval. Les JAK phosphorylent des résidus tyrosines sur le récepteur ce qui permet l'activation de différentes voies de signalisation intracellulaires, dont la voie STAT (Signal Transducers and Activators of Transcription) (Figure 2).
Figure 2. Représentation schématique des principales cibles thérapeutiques.
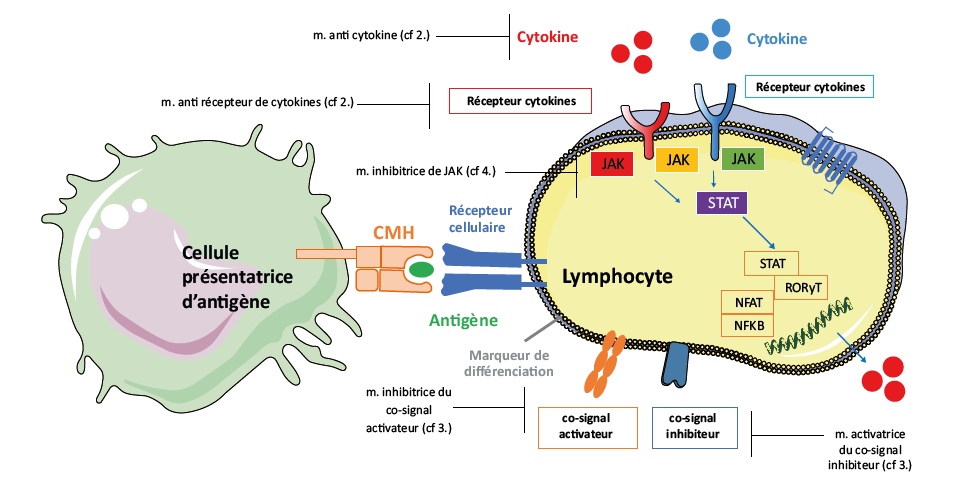
Une fois phosphorylées par les JAK, les STAT se dimérisent et migrent vers le noyau. Elles activent alors la transcription de gènes impliqués dans la réponse immunitaire.
Ainsi les JAK sont responsables :
• De l’activation des cellules immunitaires
• Du développement et de la différenciation
des cellules immunitaires
• De la modulation de la réponse immunitaire
L’arrivée des inhibiteurs de JAK (JAKi) devait engager la Rhumatologie dans une nouvelle ère. La galénique, la demi-vie courte, la rapidité d’action, l’efficacité sur un nombre important de pathologies inflammatoires faisaient des JAKi « la » molécule phare du traitement des maladies à médiation immunitaire. Mais l’engouement initial a fait place à l’inquiétude suite à la publication des résultats de l’étude « Oral surveillance »4. Cela a conduit
à des recommandations plus ou moins stringentes des différentes sociétés savantes sur la prescription de ces médicaments limitant leur utilisation.
Cependant les résultats d’Oral surveillance sont basés sur l’utilisation du tofacitinib constituant avec le baricitinib les JAKi de 1re génération. Ces molécules sont définies comme inhibiteur « pan-JAK » ciblant 2 molécules JAK (JAK1 et 3 pour le tofacitinib, JAK1 et 2 pour le baricitinib) inhibant par conséquent plusieurs voies de signalisation dont celle de l’hématopoïèse pour le baricitinib. Une des hypothèses soulevées pour expliquer l’augmentation des événements cardio-vasculaires et du risque néoplasique observés dans l’étude ORAL surveillance
était justement ce caractère non sélectif. L'Upadacitinib et le Filgotinib représentent la 2nd génération d'inhibiteurs de JAK. Ils ciblent uniquement JAK1. Les tests in vitro de sélectivité révèlent certes une profonde inhibition sur JAK1 mais malgré tout une inhibition collatérale de JAK2. JAK3 et TYK2 semblent par contre épargnés. Ces tests ne sont probablement pas un reflet exact de l’effet de ces traitements in vivo. Il n’est donc pas certain que cette propriété modifie drastiquement le profil de tolérance5. En ce sens, l’initiative de la société française de Rhumatologie avec le registre MAJIK et le registre européen JAKpot colligeant les données des patients traités par JAKi, délivreront des informations cruciales sur le risque cardiovasculaire et néoplasique sous traitement sélectif.
5- COMBINER LES BIOTHÉRAPIES, POSSIBLE MAIS À QUEL PRIX
Malgré un nombre de molécules toujours plus important, il existe un pourcentage non négligeable de rhumatismes inflammatoires réfractaires à tous traitements. On retrouve dans la littérature des cas rapportés de ce type de patients, traités par une combinaison de biothérapies. Cette situation n'est pas rare en gastro entérologie où les combinaisons de biothérapies sont utilisées chez des patients présentant une maladie inflammatoire du tube digestif associée à une autre maladie à médiation immunitaire.
Les combinaisons classiquement utilisées associent un anti TNF au Védolizumab (anti ⍺4β7 intégrine) ou à l’Ustékinumab (anti IL-12/IL-23). Les données de tolérance à disposition sont limitées compte tenu de l’absence d’essai randomisé mais le rapport bénéfice/risque semble acceptable pour ces prises en charge complexes. À titre d’exemple, dans l’étude COMBIO regroupant 143 patients souffrant d’une ou de
plusieurs maladies du spectre de la spondyloarthrite et bénéficiant d’une combinaison de biothérapies pendant en moyenne 274,5 semaines,
on observait uniquement 9 infections sévères6. Ces tentatives ouvrent la porte au concept de médecine personnalisée. Ainsi, notre capacité à mieux comprendre la physiopathologie des maladies à médiation immunitaire devrait nous amener à des combinaisons basées sur la signature immunologique des patients tout en tenant compte du profil de tolérance. Il n’est donc pas impossible qu’à l’avenir des combinaisons de biothérapies soient utilisées pour induire une rémission chez des patients réfractaires à un traitement classique.
6- MIEUX CIBLER LES LYMPHOCYTES B GRÂCE AUX CAR T-CELLS ET AUX ANTICORPS BISPÉCIFIQUES
Les CAR T-cells (ou cellules T à récepteur chimérique d'antigène) représentent probablement la révolution médicale de ces dernières années. Cette forme de thérapie cellulaire innovante est utilisée pour le traitement des hémopathies malignes principalement les leucémies et les lymphomes.
Les CAR T-cells (Figure 3) sont des cellules T génétiquement modifiées pour exprimer un récepteur chimérique (CAR) à leur surface. Ce récepteur est conçu pour reconnaître spécifiquement un antigène présent sur les cellules tumorales.
Figure 3. CAR T-cell et anticorps bispécifique
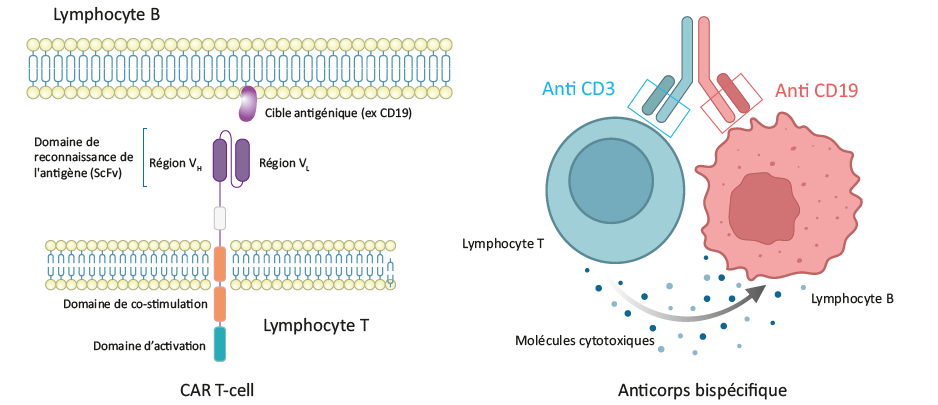
Elles se composent :
• de domaines extracellulaires : ces domaines sont responsables de la reconnaissance spécifique de l'antigène cible, qui est généralement une protéine exprimée à la surface des cellules tumorales. Par exemple, dans le cas des leucémies et lymphomes, un antigène comme CD19 est souvent ciblé ;
• de domaines transmembranaires : cette portion permet l'ancrage du récepteur à la membrane cellulaire de la cellule T ;
• de domaines intracellulaires : ils déclenchent la signalisation intracellulaire qui active la cellule T pour qu'elle attaque et détruise les cellules tumorales. Ces domaines peuvent inclure des motifs de signalisation, tels que les domaines CD3ζ et des molécules de co-stimulation (comme CD28 ou 4-1BB) qui renforcent l'activation et la prolifération des cellules T.
Leur potentiel thérapeutique s’étend maintenant aux maladies auto-immunes puisque le lymphocyte B représente comme dans les hémopathies lymphoïdes B, la cellule à l’origine des complications observées dans la plupart de ces maladies.
Récemment, l’utilisation des CAR T-cells ciblant le CD19 (marqueur lymphocytaire B) dans des maladies auto immunes extrêmement sévères et réfractaires à tous traitements a donné lieu à des rémissions spectaculaires7. Cette technologie s’imposera probablement comme le traitement de dernier recours du lupus systémique, de certaines myopathies inflammatoires ou même de polyarthrite rhumatoïde agressives et réfractaires à tous
traitements par exemple. Le coût et les nombreuses étapes de conception sont actuellement rédhibitoires hors situations « désespérées » mais il ne faut pas non plus négliger les effets indésirables liés à ce traitement. En effet, les CAR T-cells peuvent entraîner des effets secondaires graves, dont les plus fréquents sont :
• le syndrome de libération de cytokines : une réponse inflammatoire excessive pouvant entraîner de la fièvre, une hypotension, une détresse respiratoire, et d’autres complications ;
• une neurotoxicité (ICANS "Immune effector Cell-Associated Neurotoxicity Syndrome" syndrome neurotoxique associé aux cellules effectrices du système immunitaire): provoquant des effets neurologiques allant de la confusion à des crises convulsives ;
• des infections : car les cellules T sont temporairement supprimées ou modifiées, augmentant la susceptibilité aux infections.
La gestion de ces effets secondaires nécessite un plateau technique spécialisé (en particulier hématologues et réanimateurs) ayant acquis l’expérience de ces situations. On peut donc supposer qu’en rhumatologie ces traitements seront réservés à des indications très ciblées dans des centres spécialisés. Une nouvelle génération de CAR spécifiquement « designés » pour les maladies à médiation immunitaire est en cours de développement avec pour objectif de cibler uniquement les lymphocytes B autoréactifs tout en limitant les effets secondaires.
En parallèle des CAR T-cells, une technologie tout aussi novatrice a vu le jour : les anticorps bispécifiques (Figure 3)8. Ce sont des protéines recombinantes qui possèdent deux sites de liaison distincts, chacun pouvant se lier à une cible différente. Ce type d'anticorps a suscité un grand intérêt en raison de sa capacité à interagir simultanément sur deux antigènes différents, ce qui ouvre des possibilités thérapeutiques innovantes dans de nombreux domaines, notamment les maladies auto-immunes. En ciblant deux antigènes ou récepteurs spécifiques, les anticorps bispécifiques offrent une plus grande précision, avec potentiellement moins d'effets secondaires.
Les anticorps bispécifiques peuvent être conçus de différentes manières, mais la forme la plus courante est celle d'un anticorps où les domaines variables des chaînes lourdes et légères d'anticorps sont modifiés pour reconnaître deux cibles distinctes. Les mécanismes d'action des anticorps bispécifiques varient en fonction de leurs cibles :
• En hématologie, recrutement des cellules T pour la destruction des cellules tumorales via la formation d'un complexe entre la cellule T et la cellule tumorale. La formation de ce complexe déclenche l’activation de la cellule T et la libération de cytokines pro-inflammatoires qui vont conduire à la lyse de la cellule tumorale.
• En oncologie, induction de l’apoptose : un anticorps bispécifique peut induire l'apoptose de cellules tumorales, en se liant simultanément à des récepteurs spécifiques de la cellule effectrice et des molécules pro-apoptotiques sur la cellule tumorale.
• En infectiologie, neutralisation simultanée de deux cibles pathogènes
• En immunologie, modulation de la réponse immunitaire en ciblant des cellules spécifiques du système immunitaire ou en inhibant deux voies de signalisation impliquées dans la maladie.
7- UNE NOUVELLE CIBLE, LES T MÉMOIRES RÉSIDENTS ?
À la différence des maladies auto immunes où le lymphocyte B est la clé, il est plus difficile d’identifier un acteur principal dans les maladies du spectre « auto inflammatoire ».
Les cellules T mémoires résidentes tissulaires (Trm) pourraient jouer ce rôle. Cette population se distingue des cellules T présentes dans le sang périphérique par leur rétention préférentielle dans les tissus. Au niveau tissulaire, les Trm représentent un capteur immunitaire responsable de la surveillance des perturbations locales de l'homéostasie. De telles cellules ont été décrites dans la peau, l'intestin et les poumons. Les cellules Trm expriment des molécules d'adhésion et de migration, les plus fréquemment décrites étant CD69, CD103 et l'intégrine αE.
Cependant, l'expression de ces marqueurs de surface dépend largement de leur microenvironnement. Certains des marqueurs sont spécifiques au site, par exemple, l'intégrine α4β7 pour les Trm intestinales et le CXCR3 pour les cellules T résidentes de l'épithélium cutané ou pulmonaire9.
Dans le psoriasis, les Trm ont été caractérisés par l'expression de CD103 et CD69, qui contribuent à les maintenir dans la peau. Des Trm CD8+ ont été observées dans les lésions psoriasiques10 et contribuent à l'expression de l'IL-1711. Il est intéressant de noter que la sous-population de cellules CD8+CD103+CD43+ diminue après traitement par Guselkumab (anti IL-23), mais reste inchangée après traitement par Secukinumab (anti IL-17A). Ces résultats pourraient expliquer pourquoi les inhibiteurs de l'IL-23 peuvent être associés à une rémission à long terme12. Dans le rhumatisme psoriasique, des Trm synoviaux (la sous-population de cellules T CD8+CD69+CD103+) ont été identifiés comme des cellules sécrétant de l'IL-17A13. Il a été montré que les Trm CD8+ exprimaient le CXCR6, ce qui pourrait contribuer à leur rétention dans l'articulation, des taux élévés de CXCL16 (le ligand de CXCR6) étant observés dans le liquide synovial correspondant.
Ce type de données pourrait à terme conduire au développement de traitement ciblant les marqueurs des T résidents dans les pathologies auto inflammatoires.
CONCLUSION
L’offre de traitements biologiques toujours plus importante confère à la Rhumatologie une place de choix au sein de la médecine personnalisée. Alors que les innovations thérapeutiques ne cessent de nous surprendre année après année et nous permettent d’être optimiste sur le futur de la prise en charge des rhumatismes inflammatoires chroniques, le rhumatologue devra continuer à aiguiser ses connaissances immunologiques pour être un acteur central de cette nouvelle ère. La levée de la prescription initiale hospitalière renforce ce constat car elle donne directement la main au rhumatologue dans le choix du traitement biologique.
L’auteur déclare ne pas avoir de lien d’intérêt.
RÉFÉRENCES
⬧1. McGonagle D, McDermott MF. A proposed classification of the immunological diseases. PLoS Med. août 2006;3(8):e297.⬧2. Mease PJ, Genovese MC, Weinblatt ME, Peloso PM, Chen K, Othman AA, et al. Phase II Study of ABT-122, a Tumor Necrosis Factor– and Interleukin-17A–Targeted Dual Variable Domain Immunoglobulin, in Patients With Psoriatic Arthritis With an Inadequate Response to Methotrexate. Arthritis Rheumatol.1 nov 2018;70(11):1778-89.⬧3. Kulkarni SS, Falzarano D. Unique aspects of adaptive immunity in camelids and their applications. Mol Immunol. juin 2021;134:102-8.⬧4. Ytterberg SR, Bhatt DL, Mikuls TR, Koch GG, Fleischmann R, Rivas JL, et al. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis.N Engl J Med. 26 janv 2022;386(4):316-26.⬧5. Taylor PC, Choy E, Baraliakos X, Szekanecz Z, Xavier RM, Isaacs JD, et al. Differential properties of Janus kinase inhibitors in the treatment of immune-mediated inflammatory diseases. Rheumatol Oxf Engl. 1 févr 2024;63(2):298-308.⬧6. Guillo L, Flachaire B, Avouac J, Dong C, Nachury M, Bouguen G, et al. Efficacy and safety of combination targeted therapies in immune-mediated inflammatory disease: the COMBIO study. Dig Liver Dis. 1 janv 2023;55(1):61-8.⬧ 7. Müller F, Taubmann J, Bucci L, Wilhelm A, Bergmann C, Völkl S, et al. CD19 CAR T-Cell Therapy in Autoimmune Disease — A Case Series with Follow-up. N Engl J Med. 21 févr 2024;390(8):687-700.⬧8. Bucci L, Hagen M, Rothe T, Raimondo MG, Fagni F, Tur C, et al. Bispecifi c T cell engager therapy for refractory rheumatoid arthritis. Nat Med. juin 2024;30(6):1593-601.⬧9. Masopust D, Soerens AG. Tissue-Resident T Cells and Other Resident Leukocytes. Annu Rev Immunol. 26 avr 2019;37:521-46.⬧10. Fujiyama T, Umayahara T, Kurihara K, Shimauchi T, Ito T, Aoshima M, et al. Skin infi ltration of pathogenic migratory and resident T cells is decreased by Secukinumab treatment in psoriasis. J Invest Dermatol. 18 mars 2020;
⬧11. Mehta H, Mashiko S, Angsana J, Rubio M, Hsieh YCM, Maari C, et al. Differential Changes in Infl ammatory Mononuclear Phagocyte and T-Cell Profi les within Psoriatic Skin during Treatment with Guselkumab vs. Secukinumab. J Invest Dermatol. juill 2021;141(7):1707-1718.e9.⬧12. Gordon KB, Armstrong AW, Foley P, Song M, Shen YK, Li S, et al. Guselkumab effi cacy after withdrawal is associated with suppression of serum IL-23-regulated IL-17 and IL-22 in psoriasis: VOYAGE 2 study. J Invest Dermatol. 14 juin 2019;⬧13. Steel KJA, Srenathan U, Ridley M, Durham LE, Wu SY, Ryan SE, et al. Polyfunctional, Proinfl ammatory, Tissue-Resident Memory Phenotype and Function of Synovial Interleukin-17A+CD8+ T Cells in Psoriatic Arthritis. Arthritis Rheumatol Hoboken NJ. mars 2020;72(3):435-47.

