Le syndrome SAPHO, acronyme pour les termes anglais synovitis, acne, pustolosis, hyperostosis, osteitis, est une entité décrite en 1987 en France à partir de 85 cas associant une atteinte ostéo-articulaire au premier rang desquelles figurent une atteinte de la paroi thoracique antérieure et une hyperostose périphérique, et une atteinte cutanée au premier rang desquelles figurent une pustulose palmoplantaire et une acné sévère1. Le SAPHO est un syndrome très rare et très polymorphe, dont la distinction ou la similitude avec l’ostéite chronique non bactérienne porte encore à discussion, ce qui explique l’absence persistante de définition claire, validée et consensuelle, même si plusieurs système de critères diagnostiques ont été proposés1. Nous rapportons l’observation d’une patient atteinte d’un SAPHO avec une atteinte ostéo-articulaire presque exclusive de l’articulation manubriosternale chez laquelle une infection par la COVID-19 a entraîné une poussée inflammatoire ostéo-articulaire et également cutanée.
OBSERVATION
Une femme âgée de 24 ans était hospitalisé pour des douleurs sternales intenses apparues depuis 48 heures. Dans ses antécédents familiaux, on notait une maladie de Crohn et un psoriasis chez sa mère. La patiente avait eu un psoriasis cutanée dans l’enfance, mais qui avait disparu à l’âge de 14 ans. À partir de l’âge de 17 ans, était apparue une atteinte inflammatoire du sternum qui avait été diagnostiqué comme un syndrome SAPHO à l’âge de 20 ans. Dans un autre hôpital, elle avait reçu des traitements de fond par méthotrexate et étanercept, sans efficacité semble-t-il, ainsi que du
zolédronate avec une intolérance.
À l’âge de 22 ans, elle avait été hospitalisée pour la première fois dans notre service pour des douleurs inflammatoires siégeant principalement au sternum mais également au rachis dorsolombaire. Il y avait alors une douleur exquise en regard de l’articulation manubriosternale sans autre anomalie clinique, notamment cutanée. La seule anomalie biologique était un syndrome inflammatoire modéré avec une CRP à 15 mg/l. La recherche de l’antigène HLA B27 était négative. La scintigraphie osseuse montrait une hyperfixation du sternum, principalement de l’articulation manubriosternale, et des articulations sternoclaviculaires.
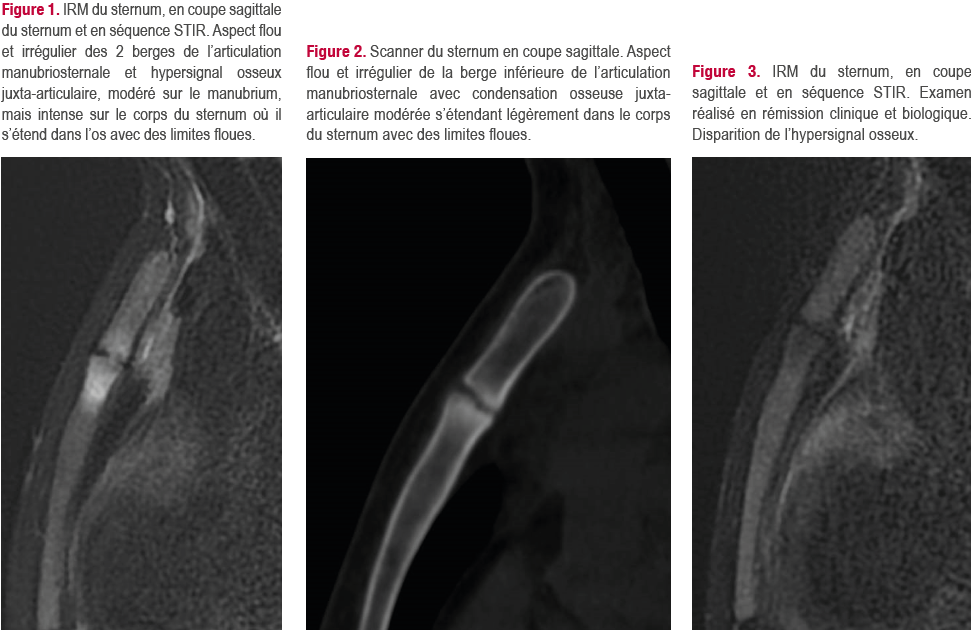
L’IRM du sternum (Figure 1) montrait, sur les séquences STIR, un aspect irrégulier des berges de l’articulation manubriosternale et un hypersignal
osseux inhomogène des berges s’étendant dans le manubrium et le corps du sternum avec des limites floues. Le scanner osseux du sternummontrait un aspect flou des berges de la manubriosternale et une condensation modérée de l’os sous-chondral, prédominant au corps du sternum comme l’hypersignal en IRM (Figure 2). La radiographie de bassin ne montrait pas de sacroiliite structurale.
Après échec du kétoprofène intraveineux, on débutait un nouveau traitement anti-TNF par infliximab (IFX, 5 mg/Kg) en association au méthotrexate (10 mg/ semaine). Ce traitement était efficace avec une importante diminution des douleurs sternales et une normalisation de la CRP. Il persistait cependant des poussées douloureuses déclenchées par un espacement des perfusions d’IFX au-delà de six semaines. Sur une IRM de contrôle réalisée 6 mois plus tard, l’hypersignal du sternum avait disparu (Figure 3).
Six mois plus tard, la patiente était hospitalisée pour la réapparition de douleurs sternales intenses survenues 3 semaines après la dernière perfusion d’IFX et cinq jours après l’apparition d’une obstruction nasale et d’une toux intense, sans fièvre. À l’examen physique, la patiente était apyrétique et il existait une douleur à la pression du sternum et de l’articulation sternoclaviculaire droite. L’examen cutané était normal. La CRP était augmentée à 10 mg/l. Une PCR nasale montrait la présence d’ARN du SARSCoV-2 porteur de la mutation L45R témoignant d’un variant Delta. Une corticothérapie était débutée, initialement à 40 mg/j pour un poids de 50 Kg, et poursuivie à dose dégressive pour une durée de 10 jours. L’évolution de la COVID-19 était bénigne avec une disparition progressive de la toux (la patiente avait reçu deux doses de vaccin contre le SARS-CoV-2 au cours de l’année précédente). Devant cette poussée, il était décidé de réaliser une nouvelle perfusion d’IFX et de rapprocher les perfusions d’IFX toutes les 4 semaines.
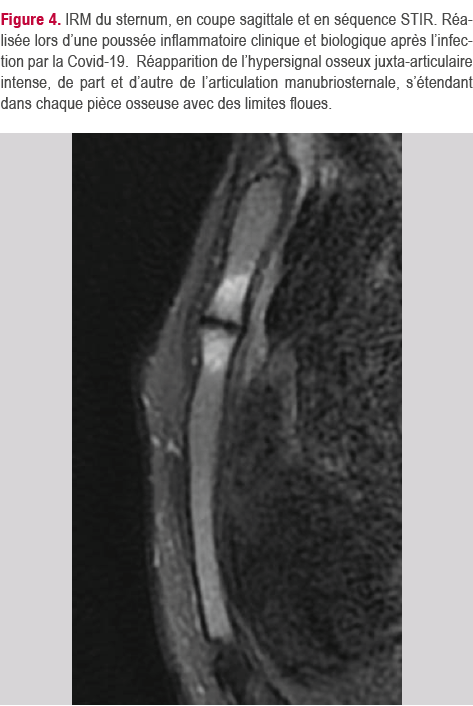
Le mois suivant, les douleurs thoraciques antérieures étaient diffuses, intenses et insomniantes, associée à quelques douleurs dorsolombaires. Des lésions de pustulose palmoplantaire (PPP) étaient apparues, de même que des lésions de psoriasis vulgaire à la lisière du cuir chevelue et au bras. La CRP était à 20 mg/l. Le dosage sérique d’IFX était dans les valeurs thérapeutique. Une nouvelle IRM du sternum montrait, sur les séquences
STIR, la réapparition d’un hypersignal intense de part et d’autre de l’articulation manubriosternale (Figure 4).
Le traitement par IFX était poursuivi et six mois plus tard, les douleurs avaient disparu et la CRP était normale, mais les lésions de PPP persistaient.
DISCUSSION
Les très grandes caractéristiques du SAPHO sont l’existence d’une ostéite focale ou multifocale aseptique, l’atteinte prédominante mais non exclusive de la paroi thoracique antérieure, l’existence très fréquente mais inconstante d’une atteinte cutanée qui peut être une pustulose palmoplantaire (PPP), une acné sévère mais aussi un psoriasis vulgaire ou une hidrosadénite suppurée1. Il n’y a pas d’association, ou une association faible, avec HLA-B271. L’atteinte de la paroi thoracique antérieure peut réaliser la classique hyperostose sterno-costo-claviculaire décrite en 1981 par Sonozaki, mais aussi une atteinte articulaire des articulations sterno-claviculaire, costosternales et manubriosternale (MST) comme chez notre patiente. L’atteinte osseuse peut entraîner une ostéosclérose, notamment à la paroi thoracique antérieure, ou une ostéolyse comme cela se voit souvent aux vertèbres.
Le SAPHO peut comporter une atteinte rachidienne et sacro-iliaque proche de celle de la spondyloarthrite axiale, avec notamment des lésions inflammatoires des coins vertébraux, une spondylodiscite aseptique, des ossifications paravertébrales et une sacro-iliite habituellement asymétrique ; elle peut aussi comporter des arthrites périphériques1. Le SAPHO apparaît donc proche des deux maladies bien individualisées que sont la spondyloarthrite axiale (axSpA) et le rhumatisme psoriasique (RPS) et certains incluent le SAPHO dans le cadre plus global des spondyloarthrites1.
Chez notre patiente, l’atteinte de la paroi thoracique antérieure atteint principalement l’articulation MST, même si l’oedème inflammatoire s’étend largement dans le manubrium et le corps du sternum et si la scintigraphie osseuse initiale montrait une hyperfixation sterno-claviculaire. Mais il n’y a pas, dans le cas de notre patiente, de véritable ostéite qui est la caractéristique principale du SAPHO2. On pourrait donc se poser la question suivante : notre patiente ne pourrait-elle pas être atteinte d’une spondyloarthrite axiale associé à un psoriasis avec atteinte palmoplantaire ou d’un rhumatisme psoriasique ?
En effet, l’atteinte clinique de la paroi thoracique antérieur est fréquente au cours de l’axSpA, même si elle ne fait pas partie des critères de classification diagnostique. Dans une étude réalisée à l’Hôpital Cochin de Paris, sa fréquence était évaluée à 37 %3. Dans la cohorte française DESIR d’axSpA récente, sa prévalence était de 44 %, et elle précédait les autres signes d’axSpA dans 14 % des cas où elle était présente4. Elle était statistiquement associée au score enthésitique et à l’atteinte clinique du rachis thoracique, mais pas à l’existence d’un psoriasis cutané. Dans une étude par IRM de la paroi thoracique antérieure, il a été mis en évidence des lésions inflammatoires de l’articulation MST chez 37 % de patients atteints d’axSpA radiographique et 22 % d’axSpA non radiographique (vs 8 % des témoins)5.
En revanche, la réalité d’une atteinte de la paroi thoracique antérieure dans le RPS est plus incertaine. Dans une revue récente, cette atteinte n’est pas mentionnée parmi les atteintes cliniques du RPS axial6, même si des publications anciennes mentionnent ce type d’atteinte dans le RPS où il s’agissait essentiellement d’une atteinte de l’articulation sternoclaviculaire. Il est probable que les patients ayant un psoriasis et une atteinte de la paroi thoracique antérieure soient le plus souvent classés comme ayant un SAPHO. De plus, l’atteinte clinique de la paroi thoracique antérieure n’est pas recherchée quand on effectue un screening pour diagnostiquer l’atteinte axiale d’un RPS, comme dans la récente étude ATTRACT7. Dans une étude rétrospective récente de 45 patients ayant un RPS axial, une atteinte de la paroi thoracique antérieure était objectivée cliniquement et par imagerie (IRM et/ou scintigraphie osseuse) chez seulement 3 patients et il s’agissait d’une atteinte de l’articulation sternoclaviculaire dans les 3 cas8.
Le tableau clinique de notre patiente, non porteuse du HLA-B27, associe donc une atteinte inflammatoire de l’articulation MST et une petite atteinte
sternoclaviculaire, sans véritable ostéite indépendante, de rares dorso-lombalgies inflammatoires et une atteinte cutanée qui est probablement un psoriasis avec atteinte palmoplantaire (mais la distinction entre PPP et psoriasis avec atteinte palmoplantaire est cliniquement assez artificielle). Son cas apparait donc à la frontière entre un véritable SAPHO et une spondyloarthrite axiale mais sans sacro-iliite. Rappelons ici les antécédents de psoriasis et de maladie de Crohn chez sa mère.
L’existence d’une poussée inflammatoire documentée de la maladie dans les suites immédiates d’une infection par la COVID-19 est une particularité originale de notre observation. Cette poussée a d’abord été ostéoarticulaire, localisée essentiellement à l’articulation MST, mais s’est ensuite étendue à la peau. La poussée inflammatoire de l’articulation MST pose d’abord la question de la responsabilité éventuelle d’un facteur mécanique lié à la toux causée par l’infection par la COVID-19. Il s’agit là d’une simple hypothèse mais que le clinicien ayant examiné la patiente lors de cet épisode ne peut exclure. Une coïncidence apparait peu probable, notamment sachant que la poussée articulaire est survenue seulement trois semaines après la dernière perfusion d’IFX. Mais la responsabilité de l’infection par la COVID-19, par le biais d’une stimulation de l’inflammation innée, est une alternative peut-être plus plausible. Il existe de nombreuses études sur un rôle éventuel de la vaccination contre le SARSCoV-2 dans les poussées des maladies inflammatoires rhumatologiques. Elles montrent l’absence d’effet ou un effet peu important et non sévère de la vaccination. En revanche, il n’existe que très peu d’études sur un rôle éventuel de l’infection par la COVID-19 dans la survenue de poussées inflammatoires des rhumatismes inflammatoires chroniques (RIC). Dans une étude italienne rétrospective ayant porté sur 362 patients (spondylarthrite ankylosante 30 %, RPS, 44 %, polyarthrite rhumatoïde 26 %) dont 32 % avait été infecté par le SARS-CoV-2, la prévalence des poussées dans le mois suivant la COVID-19 était significativement plus fréquente que chez les témoins non infectés, avec un odds ratio de 1,86 (IC95 : 1,16-3,05)9. Mais dans une étude brésilienne prospective ayant porté sur 353 patients atteints de spondyloarthrite (axSpA 2/3, RPS 1/3), dont 60 % avaient été infectés par le SARSCoV-2, il n’y avait pas de différence dans l’évolution de l’activité du RIC avant et après la COVID-19, en
comparaison avec les patients n’ayant pas été infecté10.
Les publications rapportant des poussées de RIC ou de psoriasis après la COVID-19 restent anecdotiques, malgré notre impression de clinicien que ceci n’a pas été si rare, comme d’ailleurs avec d’autres types d’infections virales.
Le traitement symptomatique du SAPHO, c’est-à-dire le traitement des douleurs ostéo-articulaires d’origine inflammatoire, fait appel aux anti-inflammatoires non stéroïdiens et éventuellement, et de manière uniquement transitoire, aux corticostéroïdes11. Les données concernant les traitements de fond du SAPHO ne proviennent que de petites séries ouvertes dont l’analyse est souvent difficile notamment du fait de l’absence de
comparateur, du caractère polymorphe des atteintes notamment ostéo-articulaires et de l’évolutivité très variable de la maladie. Le méthotrexate semble parfois ou souvent efficace sur l’état douloureux ostéoarticulaires et sur l’atteinte cutanée, mais ce bénéfice est inconstant et globalement souvent incomplet11. La sulfasalazine est inefficace. La colchicine est inefficace sur les douleurs ce qui va à l’encontre d’un rôle de l’IL-1 dans cette maladie.
Il est apparu logique d’essayer un traitement par bisphosphonate(BP) dans les formes comportant une ostéite à forme ostéolytique ou ostéocondensante. Même si les BP ont une certaine action anti-inflammatoire, leur utilisation dans des atteintes articulaires est plus discutable. Les BP n’ont évidemment pas d’action sur les atteintes cutanées. Dans une revue publiée en 2023, un total de 176 patients a été traité par BP, le plus souvent par pamidronate IV, dans 17 études11. Le pamidronate IV entraine une réduction partielle ou complète des douleurs ostéo-articulaires chez une majorité de patients et dans certaines études ceci s’associe à une rémission biologique et radiologique. Dans la majorité de ces études, le schéma comportait 3 perfusions IV de pamidronate 60 mg, trois jours de suite.
Parmi les biothérapies, les anti-IL6 sont inefficaces et les résultats des anti-IL-12/23 et des anti-IL-17 apparaissent décevants11. En revanche, il existe une large expérience de l’utilisation des anti-TNF (90 patients dans 11 études) qui est globalement favorable pour l’atteinte ostéo- articulaire11. La majorité des études rapportent une réponse clinique partielle ou complète des douleurs et de l’activité de la maladie, notamment dans les formes avec atteinte à type de spondyloarthrite. La durée optimale du traitement n’est pas connue et varie, a priori, selon chaque cas. Les anti-TNF peuvent évidemment avoir un effet très favorable sur les atteintes cutanées, mais une exacerbation des lésions de PPP ou de psoriasis n’est pas exceptionnelle, rapportée dans 10% des cas11.
Les inhibiteurs de JAK (JAKi) agissent en inhibant de nombreuses voies biologiques de l’inflammation et peuvent aussi inhiber la résorption ostéoclastique en inhibant le RANK ligand. Son utilisation dans le SAPHO apparait séduisante et ce d’autant plus que dans plusieurs publications de cas cliniques ainsi que dans une série de 16 patients atteints de PPP, les JAKi (le plus souvent le tofacitinib) entrainent des rémissions partielles ou complètes de la PPP12. De plus, en 2024, une étude rétrospective de 28 patients atteints de PPP et traités par baricitinib a montré une bonne efficacité clinique de ce JAKi avec notamment une importante amélioration de la qualité de vie13.
Plusieurs publications ont rapporté une expérience du traitement de patients atteints de SAPHO par un JAKi, qui était le plus souvent le tofacitinib, plus rarement le baricitinib et l’upadacitinib14,15. Pour exemple, Dierckx et al.14 ont rapporté en 2024 l’observation d’une patiente ayant un SAPHO (sans atteinte cutané) avec une atteinte vertébrale multi-étagée, une atteinte sternale et de la sternoclaviculaire avec hyperostose, une atteinte iliaque et un syndrome inflammatoire biologique. Un traitement par tofacitinib (5 mg x 2/j) a permis une diminution importante et rapide des douleurs ostéo-articulaires, une quasi-normalisation de l’inflammation biologique et une diminution des lésions osseuses inflammatoires à l’IRM. Après 8 mois de traitement, l’arrêt du tofacitinib, nécessité par la survenue d’une embolie pulmonaire, entrainait une réapparition des douleurs osseuses et de l’inflammation biologique. À l’occasion d’une nouveau cas clinique de SAPHO traité efficacement par un JAKi, Yang et al.15 faisaient
état, en 2024, de 15 publications identiques dans la littérature. Dans tous les cas, le traitement par JAKi était efficace, tant sur les atteintes ostéo-articulaires douloureuses que sur la PPP. L’utilisation des JAKi constitue donc une alternative possible aux anti-TNF dans le traitement du SAPHO, sans qu’il y ait d’essai contrôlé pour l’un ou l’autre de ces traitements, et en respectant les contre-indications des JAKi.
CONCLUSION
L’atteinte de l’articulation MST se rencontre dans le SAPHO et dans les axSpA. Elle peut être révélatrice et même prédominante. L’imagerie par IRM permet d’objectiver son caractère inflammatoire et l’imagerie par scanner permet de rechercher son atteinte structurale, à l’instar de l’articulation sacroiliaque.La survenue de poussées douloureuses des RIC après les infections, COVID-19 ou autres, n'est pas réellement confirmée par des études, mais nous semble peut-être sous-estimée. Les JAKi apparaissent prometteurs dans le traitement du SAPHO, notamment en présence d’une PPP.
L’auteur déclare ne pas avoir de lien d’intérêt.
RÉFÉRENCES
⬧1. Furer V, Kishimoto M, Tomita T, Elkayam O, Helliwell PS. Current and future advances in practice: SAPHO syndrome and chronic non-bacterial osteitis (CNO).Rheumatol Adv Pract. 2024 Oct 14;8(4):rkae114.⬧2. Nguyen MT, Borchers A, Selmi C, Naguwa SM, Cheema G, Gershwin ME. The SAPHO syndrome. Semin Arthritis Rheum. 2012 Dec;42(3):254 65.⬧3. Elhai M, Paternotte S, Burki V, Durnez A, Fabreguet I, Koumakis E, Meyer M, Payet J, Roure F, Dougados M, Gossec L. Clinical characteristics of anterior chest wall pain in spondyloarthritis: an analysis of 275 patients. Joint Bone Spine. 2012 Oct;79(5):476-81.⬧4. Wendling D, Prati C, Demattei C, Loeuille D, Richette P, Dougados M. Anterior chest wall pain in recent inflammatory back pain suggestive of spondyloarthritis. data from the DESIR cohort. J Rheumatol 2013;40:1148-1152.⬧5. Weber U, Jurik AG, Zejden A et al. Frequency and Anatomic Distribution of Magnetic Resonance Imaging Features in the Sacroiliac Joints of Young Athletes: Exploring "Background Noise" Toward a Data-Driven Definition of Sacroiliitis in Early Spondyloarthritis. Arthritis Rheumatol 2018;70:736-45.
⬧6. Poddubnyy D, Jadon DR, Van den Bosch F, Mease PJ, Gladman DD. Axial involvement in psoriatic arthritis: An update for rheumatologists. Semin Arthritis Rheum. 2021 Aug;51(4):880-887.⬧7. Luchetti Gentiloni MM, Paci V, Cimaroli I, Agostinelli A, Giannoni M, Campanati A, Diotallevi F, Carotti M, Sessa F, Sordillo R, Macchini C, Fiorini F, MassaccesiL, Ciferri M, Gigli M, Marconi V, Perini L, Marani A, Giovagnoni A, Polonara G, Offidani AM, Benfaremo D, Proft F, Poddubnyy D, Moroncini G. The ATTRACT study: screening for the early identification of axial psoriatic arthritis in a cohort of Italian psoriatic patients. Rheumatology (Oxford). 2024 Aug 1;63(8):2152-2161.⬧8. Fragoulis GE, Evangelatos G, Konsta M, Iliopoulos A. Anterior chest wall involvement in psoriatic arthritis: a forgotten entity? Rheumatology (Oxford)2020;59:3113-4.⬧9. Striani G, Hoxha A, Lorenzin M, Cozzi G, Scagnellato L, Vangelista T, Frizzera F, De Sandre P, Simioni P, Doria A, Ramonda R. The impact of SARS-CoV-2 infection and vaccination on inflammatory arthritis: a cohort study. Front Immunol. 2023 Jul 26;14:1207015.⬧10. Marques CDL, Ribeiro SLE, Albuquerque CP, de Sousa Studart SA, Ranzolin A, de Andrade NPB, Dantas AT, Mota GD, Resende GG, Marinho AO, Angelieri D, Andrade D, Ribeiro FM, Omura F, Silva NA, Rocha Junior L, Brito DE, Fernandino DC, Yazbek MA, Souza MPG, Ximenes AC, Martins ASS, Castro GRW, OliveiraLC, Freitas ABSB, Kakehasi AM, Gomides APM, Reis Neto ET, Pileggi GS, Ferreira GA, Mota LMH, Xavier RM, de Medeiros Pinheiro M; ReumaCoV-Brasil Registry. COVID-19 was not associated or trigger disease activity in spondylarthritis patients: ReumaCoV-Brasil cross-sectional data. Adv Rheumatol. 2022 Nov 22;62(1):45.⬧11. Li SWS, Roberts E, Hedrich C. Treatment and monitoring of SAPHO syndrome: a systematic review. RMD Open. 2023 Dec 26;9(4):e003688.⬧12. Branyiczky MK, Towheed S, Torres T, Vender R. A systematic review of recent randomized controlled trials for palmoplantar pustulosis. J Dermatolog Treat. 2024Dec;35(1):2414048.⬧13. Du N, Yang J, Zhang Y, Lv X, Cao L, Min W. Successful treatment of refractory palmoplantar pustulosis by upadacitinib: report of 28 patients. Front Med(Lausanne). 2024 Nov 6;11:1476793.⬧14. Dierckx S, Nisolle JF, Boutsen Y. Dramatic response of synovitis, acne, pustulosis, hyperostosis, and osteitis syndrome to tofacitinib monotherapy: a case report.J Med Case Rep. 2024 Feb 16;18(1):57.⬧15. Yang J, Yuan C, Zhou S, Teng Z, Li M. Successful Treatment of Refractory Synovitis, Acne, Pustulosis, Hyperostosis, and Osteitis (SAPHO) Syndrome with Baricitinib, a Janus Kinase Inhibitor. Clin Cosmet Investig Dermatol. 2024 Mar 4;17:529-537.


